
Primul dintre premiile acordate anul acesta de către Comitetul Nobel este Premiul Nobel pentru Fiziologie sau Medicină 2025 care se împarte între cercetătorii americani Mary Brunkow și Fred Ramsdell și japonezul Shimon Sakaguchi, recompensați pentru descoperirile în domeniul toleranței imunitare periferice – mecanism care împiedică organismul să-și atace propriile țesuturi. Munca celor trei este crucială pentru dezvoltarea tratamentelor medicale pentru cancer și boli autoimune, dar și pentru susținerea transplanturilor de organe.
Preluăm mai jos, în traducere și în integralitate informațiile oferite pe site-ul Nobel Prize despre evoluția și relevanța noilor descoperiri.
Despre toleranța imunitară periferică
Traducere din limba engleză de Claudia Tokacs
Sistemul imunitar este o capodoperă a evoluției. În fiecare zi, acesta ne protejează de mii de viruși, bacterii și alți microbi care încearcă să ne invadeze organismul. Fără un sistem imunitar funcțional, nu am supraviețui.
Una dintre minunile sistemului imunitar este capacitatea sa de a identifica agenții patogeni și de a-i diferenția de celulele proprii ale organismului. Microbii care ne amenință sănătatea nu poartă uniformă – toți au aspect diferit. Mulți au dezvoltat, de asemenea, asemănări cu celulele umane, ca formă de camuflaj.
Deci, cum ține evidența sistemul imunitar a ceea ce trebuie să atace și a ceea ce trebuie să protejeze? De ce sistemul imunitar nu ne atacă organismul mai frecvent?
Pentru multă vreme, cercetătorii au crezut că știu răspunsul la aceste întrebări: că celulele imune se maturizează printr-un proces numit toleranță imunitară centrală. Cu toate acestea, sistemul nostru imunitar s-a dovedit mai complex decât credeau ei.
Mary Brunkow, Fred Ramsdell și Shimon Sakaguchi – Premiul Nobel pentru Fiziologie sau Medicină 2025
Câștigătorii premiului Nobel pentru fiziologie sau medicină anul acesta au fost recompensați pentru descoperirile lor privind toleranța imunitară periferică.
Laureații au identificat gardienii de securitate ai sistemului imunitar, celulele T reglatoare, punând astfel bazele unui nou domeniu de cercetare. Descoperirile au condus, de asemenea, la dezvoltarea unor potențiale tratamente medicale care sunt în prezent evaluate în cadrul unor studii clinice. Speranța este aceea de a putea trata sau vindeca bolile autoimune, de a oferi tratamente mai eficiente împotriva cancerului și de a preveni complicațiile grave după transplanturile de celule stem.
Să pregătim scena pentru Premiul Nobel pentru Fiziologie sau Medicină din acest an și să începem cu o scurtă prezentare a ceea ce cercetătorii știau despre celulele T ale sistemului imunitar în anii 1990. Acestea, protectorii noștri vitali, se află în centrul poveștii noastre.
Celulele T – actori esențiali în apărarea organismului
Celulele T (n.r. limfocite) patrulează constant organismul. Dacă descoperă un microb invadator, ele alertează alte celule imune, care apoi lansează un atac.
Celulele T ucigașe distrug celulele infectate cu viruși sau alți agenți patogeni. Ele pot ataca și celulele tumorale.
Pe lângă ele, există și alte celule imune cu funcții diferite. Totuși, nu le vom acorda atenție, deoarece în această poveste celulele T ocupă locul central.
Senzori care pot descoperi invadatorii
Toate celulele T au pe suprafața lor proteine speciale numite receptori ai celulelor T. Acești receptori pot fi asemănați cu un tip de senzor. Folosindu-i, celulele T pot scana alte celule pentru a descoperi dacă organismul este atacat. Receptorii celulelor T sunt speciali deoarece, la fel ca piesele unui puzzle, au forme diferite. Ei sunt construiți din multe gene care sunt combinate aleatoriu. În teorie, acest lucru înseamnă că organismul ar putea produce peste 1015 receptori diferiți ai celulelor T.
Numărul mare de celule T cu receptori diferiți asigură faptul că există întotdeauna unele care pot detecta forma unui microb invadator, inclusiv viruși noi, precum cel care a declanșat pandemia COVID-19 în 2019. Cu toate acestea, organismul creează inevitabil și receptori de celule T care se pot atașa de părți ale țesuturilor proprii ale organismului.
Celulele T care recunosc țesutul propriu al organismului sunt eliminate
În anii 1980, cercetătorii au înțeles că, atunci când celulele T se maturizează în (n.r. glanda) timus, ele sunt supuse unui tip de test care elimină celulele T care recunosc proteinele proprii organismului – endogene. Acest proces de selecție se numește toleranță centrală.
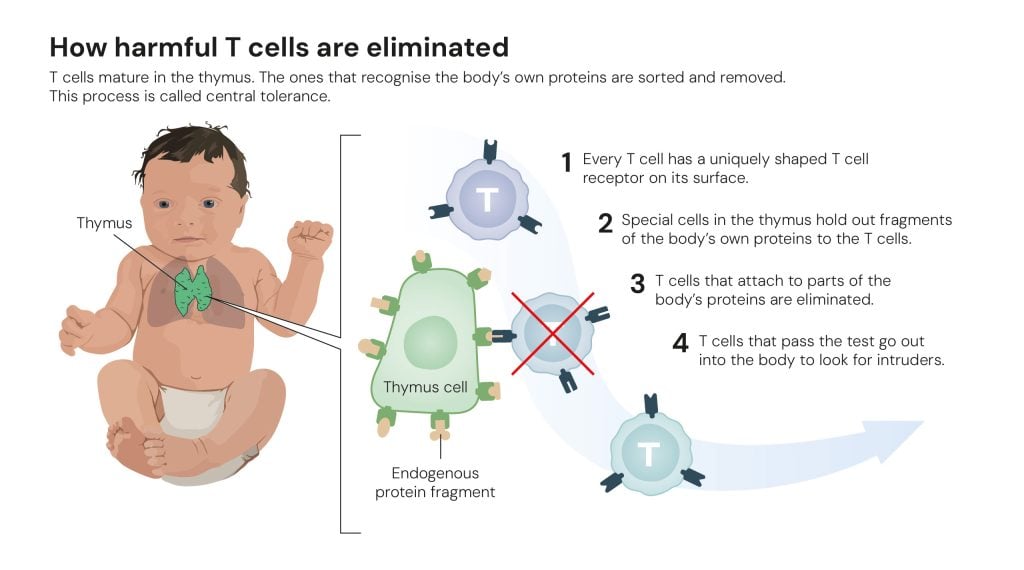
În plus, unii cercetători au suspectat existența unui tip de celule pe care le-au numit celule T supresoare. Ei credeau că acestea se ocupau de celulele T care trecuseră testul din timus. Cu toate acestea, câțiva cercetători din acest domeniu au tras concluzii nepotrivite din experimentele lor. Când a devenit evident că unele dintre dovezile privind celulele T supresoare erau false, cercetătorii au respins întreaga ipoteză, iar domeniul de cercetare a fost mai mult sau mai puțin abandonat.
Cu toate acestea, un cercetător a înotat împotriva curentului. Numele său este Shimon Sakaguchi și a lucrat la Institutul de Cercetare Aichi Cancer Center din Nagoya, Japonia.
Intuiția lui Sakaguchi: sistemul imunitar trebuie să aibă un gardian
Shimon Sakaguchi s-a inspirat dintr-un experiment anterior, contradictoriu realizat de colegii săi. Pentru a înțelege rolul timusului în dezvoltarea celulelor T, aceștia au îndepărtat chirurgical acest organ de la șoareci nou-născuți. Ei au emis ipoteza că șoarecii vor dezvolta mai puține celule T și vor avea un sistem imunitar mai slab. Cu toate acestea, dacă operația avea loc la trei zile după nașterea șoarecilor, sistemul imunitar intra în suprasolicitare și funcționa haotic, ceea ce ducea la dezvoltarea unei serii de boli autoimune la șoareci.
Pentru a înțelege mai bine acest fenomen, la începutul anilor 1980, Shimon Sakaguchi a izolat celulele T care se maturizaseră la șoareci identici din punct de vedere genetic și le-a injectat șoarecilor fără timus. Acest lucru a avut un efect interesant: se pare că existau totuși celule T care puteau proteja șoarecii de bolile autoimune.
Acest rezultat și alte rezultate similare l-au convins pe Sakaguchi că sistemul imunitar trebuie să aibă un fel de gardian de securitate, care să tempereze celulele T și să le țină sub control. Dar ce tip de celule erau acestea?
Sakaguchi descoperă o nouă clasă de celule T
Când cercetătorii diferențiază celulele T, ei folosesc proteinele situate pe suprafața celulelor. Celulele T helper pot fi recunoscute datorită unei proteine numite CD4, în timp ce celulele T killer se disting prin CD8.
În experimentul în care Sakaguchi a protejat șoarecii de bolile autoimune, el a utilizat celule cu CD4 pe suprafața lor – celule T helper. În mod normal, aceste celule trezesc sistemul imunitar și îl pun în funcțiune, dar în experimentul lui Sakaguchi sistemul imunitar a fost ținut în frâu. Concluzia lui a fost că trebuie să existe diferite forme de celule T purtătoare de CD4.
Pentru a-și testa ipoteza, Sakaguchi trebuia să găsească o modalitate de a diferenția între diferitele tipuri de celule T. Acest lucru i-a luat peste un deceniu, dar în 1995 a prezentat lumii o clasă complet nouă de celule T. În revista The Journal of Immunology, el a demonstrat că aceste celule T – care temperează sistemul imunitar – se caracterizează nu numai prin faptul că poartă CD4 pe suprafața lor, ci și o proteină numită CD25.

Această clasă de celule T recent identificată a fost denumită celule T reglatoare. Cu toate acestea, mulți cercetători erau sceptici cu privire la existența ei; doreau mai multe dovezi înainte de a crede în descoperirea lui Sakaguchi.
Informațiile cheie urmau să vină de la Mary Brunkow și Fred Ramsdell. Este momentul pentru al doilea act al Premiului Nobel pentru Fiziologie sau Medicină din 2025. Acesta începe cu nașterea unor șoareci masculi bolnavi într-un laborator din SUA în anii 1940.
O mutație provoacă o revoltă în sistemul imunitar
În acest laborator, situat în Oak Ridge, Tennessee, cercetătorii studiau consecințele radiațiilor. Munca lor făcea parte din Proiectul Manhattan și din dezvoltarea bombei atomice. Șoarecii care joacă un rol vital în Premiul Nobel din acest an au fost o întâmplare evolutivă – unii șoareci masculi s-au născut în mod neașteptat cu pielea solzoasă și descuamată, splina și glandele limfatice extrem de mărite și au trăit doar câteva săptămâni.
Soiul de șoareci – căruia i s-a dat numele scurfy – a captat atenția cercetătorilor. Genetica moleculară era încă la început, dar ei și-au dat seama că mutația care a cauzat această boală trebuie să se afle pe cromozomul X al șoarecilor. Jumătate din șoarecii masculi sunt bolnavi, dar femelele pot trăi cu această mutație, deoarece au doi cromozomi X, dintre care unul are ADN sănătos. Șoarecii femele transmit astfel mutația scurfy noilor generații.
În anii 1990, când instrumentele moleculare au devenit considerabil mai precise, cercetătorii au început să investigheze de ce șoarecii masculi scurfy se îmbolnăveau atât de grav. S-a dovedit că organele lor erau atacate de celule T care distrugeau țesuturile. Din anumite motive, mutația scurfy părea să provoace o rebeliune în sistemul imunitar.
Brunkow și Ramsdell caută explicații pentru bolile autoimune
Doi dintre cercetătorii care au devenit interesați de mutația scurfy au fost Mary Brunkow și Fred Ramsdell. Ei lucrau la o companie de biotehnologie, Celltech Chiroscience, din Bothell, Washington, SUA. Compania dezvolta produse farmaceutice pentru bolile autoimune, iar Brunkow și Ramsdell și-au dat seama că șoarecii scurfy le-ar putea oferi indicii importante în munca lor. Dacă ar fi reușit să înțeleagă mecanismul molecular care stă la baza bolii șoarecilor, ar fi putut obține informații decisive despre modul în care apar bolile autoimune. Așadar, au luat o decizie crucială: vor căuta gena mutantă a șoarecilor scurfy.
Astăzi este posibil să se cartografieze întregul genom al unui șoarece și să se găsească o genă mutantă în câteva zile. În anii 1990, era ca și cum ai căuta acul în carul cu fân. Șirul de ADN care formează cromozomul X la șoareci este format din aproximativ 170 de milioane de nucleotide cu perechi de baze. Găsirea unei mutații în această masă de ADN era posibilă, dar necesita timp, răbdare și o utilizare creativă a instrumentelor de biologie moleculară din acea perioadă.
Brunkow și Ramsdell găsesc acul în carul cu fân al ADN-ului
Cartografierea a arătat că mutația scurfy trebuie să se afle undeva în mijlocul cromozomului X. Brunkow și Ramsdell au reușit să restrângă zona potențială la aproximativ 500.000 de nucleotide. Apoi s-au apucat de munca enormă de cartografiere detaliată a acelei zone a cromozomului X.
Acest proces a durat mult timp. Când Brunkow și Ramsdell au terminat, au stabilit că zona conținea 20 de gene potențiale. Următoarea lor provocare a fost să compare aceste gene la șoareci sănătoși și la șoareci scurfy. Au examinat genă după genă. Abia la a douăzecea și ultima genă au putut striga „bingo”. După ani de muncă dedicată, au găsit în sfârșit mutația scurfy.

Gena defectă era necunoscută până atunci, dar avea multe similitudini cu un grup de gene numite forkhead box sau gene FOX. Acestea reglează activitatea altor gene, care pot afecta dezvoltarea celulară. Mary Brunkow și Fred Ramsdell au numit noua genă Foxp3.
| PROMOȚIILE ZILEI | |
 | Happy days -80% |
 | Winter Sales -90% reducere |
 | -15% EXTRA |
 | Lichidare -90% |
 | Nobel literar -20% la toate cărțile lui Krasznahorkai |
 | -20% EXTRA |
 | -50% Young art |
Descoperirea lor a dezvăluit cauza unei posibile boli grave la om.
În timpul cercetărilor, Brunkow și Ramsdell au început să bănuiască că o boală autoimună rară, IPEX, care este, de asemenea, legată de cromozomul X, ar putea fi varianta umană a bolii șoarecilor scurfy. Căutând într-o bază de date în care cercetătorii stochează informații despre gene recent descoperite, au găsit echivalentul uman al Foxp3. Ajutați de pediatri din întreaga lume, au colectat probe de la băieți afectați de IPEX. Când au cartografiat probele, au descoperit într-adevăr mutații dăunătoare în gena FOXP3.
În 2001, în revista Nature Genetics, Mary Brunkow și Fred Ramsdell au dezvăluit că mutațiile din gena FOXP3 cauzează atât boala umană numită IPEX, cât și starea de sănătate precară a șoarecilor scurfy. Aceste descoperiri cheie au dus la o activitate febrilă în mai multe laboratoare. Când cercetătorii au pus cap la cap toate piesele puzzle-ului, au înțeles că gena FOXP3 ar putea fi importantă pentru celulele T reglatoare descoperite de Sakaguchi.
Celulele reglatoare T – gardienii de securitate ai organismului
Doi ani mai târziu, Shimon Sakaguchi – și în curând și alți cercetători – au putut demonstra în mod convingător că gena FOXP3 controlează dezvoltarea celulelor reglatoare T. Aceste celule împiedică alte celule T să atace din greșeală țesutul propriu al organismului, ceea ce este important pentru un proces numit toleranță imunitară periferică.
Celulele T reglatoare asigură, de asemenea, temperarea sistemului imunitar după ce acesta a eliminat un invadator, astfel încât acesta să nu continue să funcționeze la viteză maximă.
Cunoștințele fundamentale pe care cercetătorii le-au dobândit prin descoperirea celulelor T reglatoare și importanța acestora pentru toleranța imunitară periferică au stimulat dezvoltarea unor potențiale noi tratamente medicale.
Cartografierea tumorilor arată că acestea pot atrage un număr mare de celule T reglatoare care le protejează de sistemul imunitar. Prin urmare,
Cercetătorii încearcă să găsească modalități de a demola acest zid de celule T reglatoare, astfel încât sistemul imunitar să poată accesa tumorile.
În cazul bolilor autoimune, cercetătorii încearcă, în schimb, să stimuleze formarea unui număr mai mare de celule T reglatoare.
În studiile pilot, ei administrează pacienților interleukina-2, o substanță care favorizează dezvoltarea celulelor T reglatoare. Cercetătorii investighează, de asemenea, dacă interleukina-2 poate fi utilizată pentru a preveni respingerea organelor după transplant.
O altă strategie pe care cercetătorii o testează pentru a încetini un sistem imunitar hiperactiv este izolarea celulelor T reglatoare de la un pacient și multiplicarea lor în laborator. Acestea sunt apoi înapoiate pacientului, care va avea astfel mai multe celule T reglatoare în organism. În unele cazuri, cercetătorii modifică și celule T, punând pe suprafața lor anticorpi care funcționează ca o etichetă. Acest lucru permite cercetătorilor să trimită aceste celule de securitate, de exemplu, la un ficat sau rinichi transplantat și să protejeze organul de atacul sistemului imunitar.
Există multe alte exemple de moduri în care cercetătorii testează utilizarea celulelor T reglatoare pentru combaterea bolilor.
Recomandare de carte
Dr. Elizabeth Blackburn, laureată Nobel pentru medicină în 2009, a descoperit telomeraza, enzima care hrănește și întregește telomerii, terminațiile cromozomilor, ce au rolul de a păstra tinerețea și de a proteja integritatea materialului genetic. Lungimea și sănătatea telomerilor sunt esențiale pentru sănătatea și longevitatea organismului uman.
Cartea sa arată că exercițiile fizice, calitatea somnului, alimentația și chiar anumite substanțe chimice ne afectează profund telomerii. Simultan stresul cronic, gândurile negative, relațiile tensionate și chiar mediul social în care trăim au efecte distructive asupra acestora.

Dr. Elizabeth Blackburn a primit în 2009 Premiul Nobel pentru Medicină, împreună cu doi colegi, pentru descoperirea telomerazei și a rolului telomerilor în procesul îmbătrânirii. În 2007, a fost inclusă de revista TIME în lista celor mai influenți 100 de oameni ai planetei.
Mary E. Brunkow, născută în 1961. Doctorat la Universitatea Princeton, Princeton, SUA. Manager senior de program la Institutul pentru Biologie Sistemică, Seattle, SUA.
Fred Ramsdell, născut în 1960. Doctorat în 1987 la Universitatea din California, Los Angeles, SUA. Consilier științific, Sonoma Biotherapeutics, San Francisco, SUA.
Shimon Sakaguchi, născut în 1951. Doctor în medicină în 1976 și doctor în științe în 1983 la Universitatea Kyoto, Japonia. Profesor emerit la Centrul de Cercetare de Frontieră în Imunologie, Universitatea Osaka, Japonia.
Dă-i înainte cu Răsfoiala
Top 7 cărți despre noi începuturi și vieți recâștigate
RECENZIE Când corpul spune nu, Gabor Mate – CARTEA DE SĂNĂTATE A ANULUI 2021

